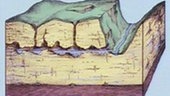
Der Schiefer wird schon seit langem in zahlreichen Steinbrüchen abgebaut. Sog. "Fleins", etwa 15 cm starke, harte Schichten innerhalb des Lias epsilon waren erster Anlaß zur Steinbruchtätigkeit und wurden früher als Bodenbeläge (Burg Hohenstaufen), Fensterbänke, Abdeckplatten etc. genutzt.
Um das Jahr 1600 versucht ein gewisser Panthaleon Keller aus dem Schiefer Öl zu schwelen.
"Um 1650 wurde in einer Schiefergrube 1/4 Stunde vom Boller Bade, durch unvorsichtiges Feuerlegen der Boden ergriffen, niemand wußte diesem Brande zu wehren, man stand sogar in Sorge, derselbe möchte das Wunderbad ergreifen. Der Herzog selbst nahm davon Augenschein. Endlich nach 6 Jahren löschte die Glut von selber, und während dieser Zeit floß aus dem Boden ein Öl, welches die Leute für Steinöl verkauften."
So berichtet Quenstedt, dieser berühmte Geologe des vergangenen Jahrhunderts, von dem die erste sehr vollständige Beschreibung des Schwäbischen Jura stammt. Von ihm stammen die Bezeichnungen Schwarzer, Brauner und Weißer Jura sowie die Einteilung jeder dieser Abteilungen in sechs Stufen ( * - * ) und noch weiter in einzelne Schichten, den Lias * z. B. in Seegrasschiefer, eigentlichen Ölschiefer und Leberboden. Auch in der angewandten Geologie hat sich dieser Geologe große Verdienste erworben. Er regte in der Mitte des 19. Jh an, Öl aus Posidonienschiefer zu destillieren. Tatsächlich gelang das bei Reutlingen, mußte jedoch bald wieder aufgegeben werden, weil das eben entdeckte amerikanische Erdöl den Preis so stark drückte, daß die aufwendige Destillation nicht mehr rentabel war. In den 70er Jahren (19 Jh.) wurde bei Reutlingen eine kombinierte Nutzung zur Mineralölgewinnung, Energiegewinnung und Zementfabrikation versucht. Daneben liefen Versuche aus Schiefer und Steinkohle im Verhältnis 5 : 1 sogenanntes "Schiefergas" herzustellen und zu Brennzwecken zu nutzen.
Besonders während und nach dem I. Weltkrieg bemühten sich die Gaswerke von Hechingen, Göppingen, Tübingen, Stuttgart u.a. um entsprechende Verfahren. Die im Zeitraum zwischen 1917 und 1923 in Württemberg durchgeführten Untersuchungen haben ergeben:
1. Die Abschwelung des Schiefers, d.h. Erhitzen unter Luftabschluß auf 450 - 500°C liefert hochwertiges Öl und hochwertiges Gas. Der Wirkungsgrad ist aber sehr schlecht. Es können theoretisch 50 %, praktisch kaum 30 - 40 %, der Energie des im Schiefer enthaltenen Kerogens genutzt werden. Vergleichsweise große Mengen der im Schiefer enthaltenen organischen Bestandteile verbleiben dabei als Restkohlenstoff in der Schlacke.
2. Bei Erhitzen des Schiefers auf 1000 - 1300 °C unter Luftabschluß entweicht der gebildete Öldampf und wandelt sich bei diesen hohen Temperaturen in Ölgas um. Gleichzeitig wird aus den Carbonaten Kohlendioxid freigesetzt, das sich mit dem Restkohlenstoff, der unter diesen Bedingungen nicht flüchtig wird zu Kohlenmonoxid umgesetzt. Durch die dazu erforderlichen höheren Temperaturen ist der Wirkungsgrad bei der Entgasung schlechter und lag bei Versuchen, die in Tailfingen und Stuttgart 1919 durchgeführt wurden bei 20 %.
3. Durch Einblasen von Luft und Wasserdampf nach Erhitzen auf ca. 1200 °C wird der Restkohlenstoff des Schiefers zu Kohlenmonoxid oxidiert und Wasserstoff wird aus dem eingeblasenen Wasserdampf frei. Diesem Gasgemisch können die bei der Erwärmung des Schiefers zwangsläufig entstehenden Öldämpfe hinzugefügt werden. Bei diesem Verfahren entsteht gleichzeitig hochwertiges Öl. Es konnten auf diesem Wege 70 % der organischen Bestandteile des Schiefers genutzt werden.
Als Ergebnis dieser Untersuchungen läßt sich zusammenfassend ableiten, daß aus dem württembergischen Ölschiefer auch unter günstigsten Bedingungen kaum nennenswerte Mengen an Öl gewonnen werden können. Alle Versuche scheiterten letztlich an der zu geringen Wirtschaftlichkeit. Aus diesem Grund wandelte sich auch das ursprüngliche Produktionsziel- Ölgewinnung, und man legte in den späten 20er Jahren das Gewicht mehr auf die Herstellung von Zement und Kunststeinen. Kleinere Werke, die aus ausgeschweltem Schiefer und Zement laufend Bausteine herstellten bestanden in Holzheim, Mössingen, Bodelshausen und Schömberg.
Verfahren der Ölgewinnung aus Ölschiefer
Es bestanden im Mai 1944 nebeneinander drei verschiedene, konkurrierende Verfahren zur Ölgewinnung aus Schiefer: Ölschieferverschwelung in Schachtöfen (bei Frommern), Untertageverschwelung (bei Schörzingen) und das sogenannte Meilerverfahren (Versuchsanlage bei Schömberg). Alle Methoden befanden sich zu der Zeit noch im Versuchsstadium.
Meilerverfahren
Unter dem Decknamen "Wüste" wurde nun in der Folgezeit für das Meilerverfahren der größte Aufwand getrieben, da es am weitesten gediehen schien und in kleinem Maßstab bereits erprobt worden war (Versuchsanlage in Schömberg). Vor der großtechnischen Durchführung standen noch zahlreiche Probleme an, z.B. Korrosion der Rohre durch saure Nebel etc. Diese Schwierigkeiten sollten beim großtechnischen Ansatz gelöst werden.
- "WÜSTE 2" Bisingen
- "WÜSTE 4" Erzingen
- "WÜSTE 8" Dormettingen
- "WÜSTE 9" Schömberg
Aktivitäten zur Schieferölgewinnung im II. Weltkrieg
Aktivitäten zur Schieferölgewinnung im 2. Weltkrieg
Nach Motika in Foth - verändert
Aufbau eines Meilers
SWR
Beim Meilerverfahren wurde Schiefer im Tagebau gebrochen, gemahlen und im freien Gelände zu Meilern (ähnlich Holzkohlemeilern) geschichtet, in die Absaugrohre ragten. Die Oberfläche der Meiler mußte zur Zündung mit einer Schicht brennbaren Materials bedeckt werden, wozu man Torf bzw. Braunkohle einsetzte. Nach der Entzündung von oben schwelten die Meiler durch das gleichzeitige Absaugen von unten durch. Die dabei durch den Schiefer wandernde Wärmefront führte zum Austreiben des Öls, das anschließend gesammelt und aufgearbeitet wurde. Der Wirkungsgrad dieses Verfahrens war allerdings sehr gering, da zur Produktion von 1 t Schieferöl etwa 35 t Schiefer aufgearbeitet werden mußten. Von den ursprünglich geplanten und in Angriff genommenen 10 Wüstenwerken zwischen Reutlingen und Rottweil konnten nur vier die Produktion von Schieferöl tatsächlich aufnehmen:
- "WÜSTE 2" Bisingen
- "WÜSTE 4" Erzingen
- "WÜSTE 8" Dormettingen
- "WÜSTE 9" Schömberg
Ständige Tieffliegerangriffe und die Schwierigkeiten, notwendiges technisches Gerät zu beschaffen (Eisenrohre, Destillationsanlagen, Pumpen), verhinderten die Inbetriebnahme aller Werke.
Idealplan eines Meilerwerkes
SWR
Ölschieferverschwelung in Schachtöfen (Frommern)
Hier strebte die Lias-Ölschiefer-Forschungsgesellschaft, die im September 1942 gegründet worden war und deren Werk sich 1944 noch im Aufbau befand, eine Verschwelung des Schiefers in Schachtöfen an. Die Ölschieferanlieferung zur Schwelanlage erfolgte per Schiene. In einer Werkshalle wurden 28 Öfen in zwei Reihen gebaut (Durchmesser jeweils 3m; Höhe 6,5m). Sie hatten jeweils unten einen Rost, waren nach oben offen und wurden befüllt in Wasserverschlüsse eingesetzt. Die Schwelung erfolgte nach Anzünden von oben bei gleichzeitigem Absaugen von unten. Die ausgeschwelten Öfen wurden ausgehoben, die Schwelschlacke ausgeleert und verhaldet. Anschließend erfolgte das Wiedereinfüllen, Einsetzen und Entzünden der Schachtöfen.
Untertageverschwelung (bei Schörzingen)
Die Kohle-Öl-Union Busse KG war im Juli 1943 gegründet worden. Kleinversuche zu Vertikal- und Horizontalschwelungen wurden im Ölschieferbruch in Göppingen Holzheim durchgeführt und sollten zunächst klären, ob die Schwelung unter Tage das anstehende Ölfeld nicht gefährdet. Der Großversuch wurde bei Schörzingen südlich von Balingen angesetzt. Die Vertikalschwelungen in senkrechten Schächten unter Tage führten weder in Holzheim noch in Schörzingen zum Erfolg. Zur Horizontalverschwelung war geplant zwei Strecken aufzufahren, eine 2m mächtige Schicht des Schiefers zu gewinnen und die hangenden Partien zu Bruch zu werfen. Die Schwelung selbst sollte so erfolgen, daß das Streb von der oberen Strecke gezündet wird und die Gase nach der unteren Strecke durch den Streb gezogen und dort kondensiert werden. Zur Zündung experimentierte man mit heißen inerten Gasen und mit elektrischem Strom. Bei den Schwelversuchen gewann man in Schörzingen ca. die Hälfte des theoretischen Ölgehalts von 5%. Das Schwelgut wurde nicht durch zu Bruchwerfen erhalten, sondern von Hand (!) eingebracht.
Schwarz-weiß Aufnahme einer Fabrik
Initiative Gedenkstätte
Im Jahre 1934 erarbeitete ein gewisser Freiherr von Krüdener als Sachverständiger in Treibstofffragen ein Gutachten, das wieder die Möglichkeiten der Ölgewinnung aus dem Lias e untersuchte. Dies geschah bereits zum damaligen Zeitpunkt im Zusammenhang mit den Kriegsplanungen und der von den Machthabern angestrebten Autarkie. Freilich war 1934 Öl aus anderen Quellen noch weitaus billiger zu beziehen, so daß der Ölschiefer zunächst nur wenig Beachtung fand. Durch den Verlust der rumänischen Ölfelder und die gezielte Bombardierung der Kohlehydrierungsanlagen bei Pölitz und Leipzig (Leuna-Werke) änderten sich im Verlauf des Jahres 1944 die Voraussetzungen.
Die Produktion von Flugbenzin im 3. Reich war zentralisiert auf wenige Hydrierwerke, die im wesentlichen auf Steinkohlebasis Flugbenzin herstellten. Schon in der Vorkriegszeit waren diese Anlagen nach rein ökonomischen Gesichtspunkten errichtet worden. Sie boten bei Einsetzen der Alliierten Luftoffensive mit ihren weithin sichtbaren Schornsteinen gut auszumachende Ziele. Jeweils nach Wiederaufbau zerstörter Anlagenteile erfolgte die nächste Angriffswelle und störte die Produktion erneut.
Quellen der dt. Mineralölversorgung im 1. Vierteljahr 1944 in 1000 t| Quelle | Flug- benzin | Kfz- benzin | Diesel Kraftstoff | Heizöl | Schmieröl | sonst. Produkte | insgesamt |
|---|
| Synthese | 503 | 315 | 200 | 222 | 14 | 228 | 1482 |
| Inländische
Rohölraffination | 1 | 43 | 111 | 9 | 211 | 137 | 512 |
| Einfuhr von
Mineralöl- produkten | 42 | 271 | 185 | 47 | 40 | 165 | 750 |
| Summe | 546 | 629 | 496 | 278 | 265 | 530 | 2744 |
| Anteil der
Hydrierung und Synthese
in v.H. | 92 | 32 | 36 | 80 | 5 | 25 | 39 |
Anteil der Hydrierung in % im ersten Vierteljahr & 1944
SWR
Ende Mai 1944 zeichnete sich der Zusammenbruch der deutschen Treibstoffversorgung ab. Da die Deckung des Bedarfs von Wehrmacht und Luftwaffe nicht mehr gewährleistet war, forcierte die damalige politische Führung alle Vorhaben, die die Chance boten, die aufgetretenen Versorgungslücken schließen zu helfen. Den "Endsieg" vor Augen spielten jetzt wirtschaftliche Überlegungen bei der Treibstoffgewinnung keine Rolle mehr. Edmund Geilenberg, der frühere Vorsitzende des Hauptausschusses für Munition, wurde im Juni 1944 zum "Generalkommissar für Sofortmaßnahmen" ernannt und mit umfassenden Vollmachten ausgestattet. Neben dem Schutz und dem Wiederaufbau der bestehenden Anlagen zur Treibstoffgewinnung, sollten auch bisher nicht genutzte Reserven in Angriff genommen werden. Man sah u.a. vor, durch Schwelung aus Ölschiefer Öl zu gewinnen.
Produktion wichtiger Zweige der Mineralölindustrie und abgeworfene Bombenlast auf die Mineralölwerke| Monat | Erzeugung Flugbenzin (in 1000t) | Erzeugung Kfz.-Benzin (in 1000t) | Erzeugung Dieselöl (in 1000t) | Abgeworfene Bombenlast (in short tons) |
|---|
| Januar 1944 | 159 | 118 | 117 | 114 |
| Februar 1944 | 164 | 106 | 94 | 81 |
| März 1944 | 181 | 134 | 100 | 0 |
| April 1944 | 175 | 126 | 89 | 570 |
| Mai 1944 | 156 | 94 | 74 | 5146 |
| Juni 1944 | 52 | 75 | 69 | 17697 |
| Juli 1944 | 35 | 48 | 69 | 21404 |
| August 1944 | 17 | 59 | 69 | 26320 |
| September 1944 | 10 | 48 | 52 | 10997 |
| Oktober 1944 | 20 | 53 | 57 | 12542 |
| November 1944 | 49 | 50 | 55 | 35023 |
| Dezember 1944 | 26 | 50 | 66 | 13900 |
| Januar 1945 | 11 | 50 | 64 | 12505 |
| Februar 1945 | 1 | 50 | 77 | 22635 |
| März 1945 | 0 | 39 | 39 | 30937 |
Die Arbeitskräfte, die man zur Ölgewinnung einsetzte, waren KZ-Häftlinge für die die SS zu sorgen hatte. Die sieben Lager des südwürttembergischen Schieferölprogramms gehörten zu den letzten KZs, die das nationalsozialistische Terrorsystem errichtete. Das Lager Dormettingen wurde im Januar 1945 zu einem Zeitpunkt erstellt, als Auschwitz kurz vor der Befreiung stand. Anfang April, also nach knapp drei Monaten, wurde es evakuiert. Zwei Wochen später standen alle Lager leer.
Konzentrationslager
Für die Gefangenen allerdings endete die Zeit ihrer KZ-Haft in einem letzten Höhepunkt der Schikane, den Evakuierungsmärschen zwischen dem 17. und dem 23. April 1945. Die Lager waren keine Vernichtungslager wie Auschwitz oder Treblinka, sie hatten nicht die Größe von Dachau oder Buchenwald. Und doch starben dort, "vernichtet durch Arbeit", Tausende von Menschen. Die Häftlinge stammten aus fast ganz Europa. Aus Stutthof / Danzig wurden die letzten Überlebenden der jüdischen Bevölkerung Litauens, aus Auschwitz und Buchenwald, polnische Juden und Überlebende des Warschauer Aufstandes in die Lager gebracht und über Dachau ungarische Juden. Daneben zählten auch Mitglieder der Widerstandsbewegung Westeuropas und Skandinaviens zu den Häftlingen dieser Konzentrationslager.
Die Verhältnisse waren in allen Lagern unmenschlich. Dennoch ergibt sich aus den Zeugenberichten ein differenzierteres Bild. Das hing einerseits von äußeren Bedingungen ab, wie das jeweilige Lager eingerichtet war. Andererseits gab es auch, was die Lagerführung anbelangte, Unterschiede.
Die ersten drei dieser Lager standen im Zusammenhang mit den drei Versuchsanlagen: Schömberg, Frommern und Schörzingen. Belegt wurden diese kleinen KZs zunächst mit Häftlingen aus dem Stammlager Natzweiler-Struthof. Vergleichsweise erträglich scheint es im Lager Frommern und im Lager Schömberg (dem sog. Bahnhofs-KZ) zugegangen zu sein. Über die Verhältnisse dort berichtete der ehemalige Häftling Christophe Hornick unter anderem: "Ohne je zu schreien und natürlich ohne zu schlagen, leitete er (der Lagerälteste) das Lager; er hielt die Ordnung mit diplomatischem Geschick aufrecht, mit dem Erfolg, daß es von nun an fast keine Toten mehr gab" (nach LEMPP et. al. 1991).
Durch das schnelle Vorantreiben des Ölschieferprojekts "Wüste" im Verlauf des Jahres 1944 änderten sich jedoch die Verhältnisse. Vor allem die Lager, die noch zusätzlich errichtet wurden, gehörten nach den Berichten von Überlebenden, die in verschiedenen Lagern waren, zu den schlimmsten, die sie erleben mußten. Die KZs von Dautmergen und Bisingen bestanden, als die ersten Häftlinge ankamen, lediglich aus einer Reihe von Fliegerzelten, die von Stacheldraht und Wachtürmen umgeben waren. Schon nach wenigen Wochen wurden die Lager im regnerischen Herbst des Jahres 1944 zu Schlammwüsten, in denen die Gefangenen morgens bei den Appellen oft bis zu den Knien im Morast standen.
Hinzu kam die völlig unzureichende Bekleidung, die lediglich aus einem dünnen Drillichanzug und Holzschuhen bestand, sowie die ebenso unzureichende Ernährung. "Morgens", so der Bericht eines Überlebenden," ein halber Liter warmes braunes Wasser, genannt Kaffee, hierzu eine Scheibe Brot, zuweilen auch gar nichts oder einen kleinen Löffel voll Marmelade, mittags und abends Kohlrübensuppe ohne Fett und Fleisch, nur gelegentlich angereichert mit Kartoffeln oder Nudeln." (nach ZEKORN, Zollernalbkurier vom 4.4.1992)
Machten schon Bekleidung, Ernährung und Unterkunft das Leben in den KZs kaum ertragbar, so wurde es durch die Willkür und Brutalität der SS-Wachmannschaften vollends zur Hölle. Wer es wagte, sich gegen die Kälte Zementsäcke unter die Kleidung zu stopfen, wurde mit Stockschlägen bestraft. Flüchtende erschoß man sofort oder meldete sie zur Bestrafung nach Natzweiler ins Stammlager.
Unter diesen unmenschlichen Bedingungen mußten die Häftlinge Tag für Tag Zwangsarbeit für den Aufbau und Betrieb der Ölschieferwerke leisten. Die schwere körperliche Arbeit zusammen mit den unsäglichen hygienischen Verhältnissen, der völlig unzureichenden medizinischen Versorgung und den unmenschlichen Lebensverhältnissen führten innerhalb sehr kurzer Zeit zum Auftreten von Seuchen und zu einer sehr hohen Sterblichkeit unter den Häftlingen.
KZ-Arbeitsbedingungen
In den Wüsten-Werken und KZs wurden Tausende Häftlinge zu Tode gequält. 12 Stunden Zwangsarbeit im Steinbruch, ohne Mittagessen, ohne sauberes Trinkwasser. Wer zu langsam arbeitete oder hinfiel, wurde geprügelt. Schwerkranke brachte man mit einer Giftspritze um. Menschenleben spielten keine Rolle auf dem Weg zum Endsieg. Die Zentren der Energieversorgung lagen in den letzten Kriegsjahren in Rumänien und im Raum Leipzig. Doch ab 1943 stießen englische und amerikanische Flugzeuge bis weit hinter die Front vor. Ihre Bomben halbierten die Benzinvorräte des Deutschen Reiches auf einen Schlag. Die Wehrmacht hatte nicht mehr genug Treibstoff für Panzer und Flugzeuge. Unterhalb der Burg Hohenzollern lag Deutschlands letzte Hoffnung, der Ölschiefer. Hitler befahl seine Nutzung. Nur ein knappes Jahr vor Kriegsende wurden eiligst zehn Fabriken hochgezogen, obwohl die Technik zur Gewinnung von Schieferöl kaum erprobt war. KZ- Häftlinge mußten die Meiler aus Ölschiefer aufhäufen.
Menschenverachtendes und Zivilcourage
Mit Korruptheit und Sadismus herrschten Wachpersonal und Kapos. Wie man trotzdem in einem solchen Milieu der Menschenvernichtung an verantwortlichster Stelle gegen den Strom schwimmen konnte, ist am Beispiel des Lagerkommandanten von Dautmergen Erwin Dold zu sehen. Er war ab dem Spätherbst 1944 Lagerleiter in Dautmergen. Als Feldwebel der Wehrmacht, ohne Parteibuch und SS-Mitgliedschaft, wurde er nach einer Verwundung an der Front an diese Stelle zwangsversetzt. In einer Reihe gewagter Unternehmungen konnte er die Not der Lagerinsassen wenigstens vereinzelt lindern. Mit viel Zivilcourage sorgte er heimlich für Nahrung, Medikamente und Kleidung. Als die SS-Angehörigen im Rastatter Kriegsverbrecherprozeß 1946 verurteilt wurden, war der Lagerführer von Dautmergen der einzige, der freigesprochen wurde. Auch Teile der Bevölkerung der umliegenden Gemeinden versuchten die Not der Gefangenen etwas zu lindern. Ständig in der Gefahr, von Denunzianten verraten und selbst in eines der Lager gesteckt zu werden, halfen Bürger, indem sie z.B. flüchtende Häftlinge versteckten oder auf den Feldern, die zu Tagebaustätten wurden, Äpfel und Kartoffeln zurückließen. Die genaue Zahl der KZ-Häftlinge, die in den Lagern der "Wüsten" umkamen, ist unbekannt. Sie dürfte aber bei über 3500 liegen.
Zeugen der Vergangenheit
Mehrere Gedenkstätten erinnern an diese sinnlosen Opfer des "totalen Krieges". Weitere Überbleibsel der damaligen Schieferölgewinnung sind: eine ganze Anzahl von KZ-Gebäuden (Schömberg beim Bahnhof), Mauerreste von Betriebsanlagen (Wüste 10 - Zepfenhan, Gedenkstätte Eckerwald), Meiler bzw. in Meilern entstandene Schlacken (Wüste 4 - Erzingen, südlich der Domäne Bronhaupten) und junge Aufforstungen, die im Zuge der Rekultivierung der wüst gefallenen Flächen entstanden. Beim Vergleich alter und neuer topographischer Karten werden darüber hinaus morphologische Veränderungen sichtbar: z.B. Begradigung eines Flußlaufs (Schlichem), Verlagerung von Geländestufen (Bisingen), etc.
Der Meiler gehörte zum "Unternehmen Wüste". Unter diesem Tarnnamen wurden im Vorland der Schwäbischen Alb zehn Ölschieferwerke gebaut. In unmittelbarer Nähe: Sieben Konzentrationslager. Unter Aufsicht der SS mußten über zehntausend Häftlinge in den Ölschiefer-Steinbrüchen zwangsarbeiten. Die meisten Häftlinge der Konzentrationslager gehörten zur Kategorie NN, Nacht und Nebel - soviel wie ein Todesurteil. In Nacht und Nebel-Aktionen wurden sie aus ihrer Heimat verschleppt und in Nacht und Nebel sollten sie verschwinden. Das 'Verbrechen' dieser Luxemburger: Sie wehrten sich gegen die Nazi-Besatzung. Charles Hausemer und Helge Norseth kehrten wieder zurück an den Ort ihrer Pein.
Charles Hausemer 1997
SWR - Screenshot aus der Sendung
Zitat Hausemer:
"Wir brachen Schiefer. Und das ging so: Wir mußten einen Graben ausgraben. Ein Meter breit und ein Meter tief. Jeder bekam einen Abschnitt, der nächste Mann war etwa 10 Meter entfernt. Und das Pensum des Tages war, man mußte dann seinen Vormann erreichen, das waren 10 Kubikmeter, die man ausheben mußte, das war das Pensum des Tages." (Frage: "War das zu schaffen ?") "Sehr sehr schwer, wir hatten bloß 'ne Hacke und Schaufel, um Schiefer zu brechen, und dann war's noch schlimmer, war's im Winter, man stand immer im Wasser, das war sehr sehr schlecht in dieser Zeit."
"Der Haufen wurde angezündet, und dann wurden die Gase durch diesen Haufen angesaugt, und die Flamme, die Glut, die fraß sich langsam in den Haufen rein. Und dann waren die Gase, die kamen dann durch den Ventilator in so runde Behälter, innen waren Elektroden, 70.000 Volt Gleichstrom, und der Gas ionisierte sich und das Öl lief an den Wänden runter."
Das Unternehmen Wüste war Hitlers letzte Hoffnung. Doch bis Kriegsende wurden nur 1.500 Tonnen Öl aus Schiefer gewonnen, bei einem gigantischen Aufwand: Um eine Tonne Öl zu produzieren, mußten 50 Tonnen Ölschiefer verschwelt werden. Daran konnten auch die Spezialisten der Nazi-Organisation Todt nichts ändern, erinnert sich Helge Norseth, ein ehemaliger KZ-Häftling aus Norwegen.
Helge Norseth:
"Einer von Organisation Todt, er war Berliner, der sagte 'ein totgeborenes Kind', wie konnte man von Schieferöl die riesengroße Kriegsmaschine mit Energie versorgen, das war Wahnsinn, eigentlich, das war nur, um Menschen zu töten."
Im Häftlingsbuch notierte die SS fein säuberlich alle Sterbedaten. Hier findet Helge Norseth die Namen seiner norwegischen Mitgefangenen, die im KZ starben. Im Ölschiefergebiet wurden insgesamt 3.500 Häftlinge zu Tode geschunden.
Nach dem Krieg ließ die französische Armee die Massengräber wieder ausheben, um der deutschen Bevölkerung die Verbrechen der Nazis drastisch vor Augen zu führen und um die Toten würdig zu begraben. Am Fuß der Burg Hohenzollern lag das Konzentrationslager Bisingen. Mehr als 50 Jahre nach Kriegsende besuchen erstmals Überlebende der KZs den Friedhof, wo ihre Mitgefangenen begraben wurden. Über 50 Jahre hat es gedauert, bis eine Gruppe Deutscher die ehemaligen Häftlinge einlädt und betreut. Und über 50 Jahre hat es gedauert, bis der Schmerz diesen Besuch zuläßt.
SWR - Screenshot aus der Sendung
Im April 1945 übernahm die französische Besatzungsmacht das Ölschieferprojekt. Das Schwelwerk mit Raffinerie in Frommern (Verschwelung in Schachtöfen) brachte man bis 1948 auf eine monatliche Leistung von 500 Tonnen Öl. Dabei waren es nur einige tausend deutsche Internierte des Lagers Balingen, die als billige Arbeitskräfte dienten.
Angeforderte Zuschüsse von der Landesregierung von Württemberg-Hohenzollern scheinen vor allem dazu verwendet worden zu sein, um hier Forschungsarbeiten durchzuführen, die der französischen Industrie zugute kamen. (So lautet zumindest eine Pressemitteilung aus dem Balinger Volksfreund vom 29.6.1957.) Als die Zwangsverwaltung aufgelöst wurde, entschloß sich das Land Württemberg-Hohenzollern, das Werk weiterzuführen. Man ließ sich dabei vor allem von der Absicht leiten, den mehr als 1000 Menschen, die im Werk Frommern beschäftigt waren, ihren Arbeitsplatz zu erhalten. Aber obwohl größere Summen ausgeworfen wurden, um das Werk zu sanieren, blieb es ein Zuschußbetrieb. Man versuchte die Abfallprodukte zu verwerten, Bauplatten herzustellen sowie Salben gegen Entzündungen. Letztlich blieben alle Bemühungen des Werkes, schwarze Zahlen zu schreiben, erfolglos. Der Landtag beschloß die Auflösung. Es wurden alles in allem 246 Hektar landwirtschaftlicher Nutzfläche an die vorherigen Besitzer zurückgegeben. 40 Hektar davon konnten allerdings nicht mehr bestellt werden und wurden aufgeforstet. Die Bauern erhielten ebenso wie die Firmen, die bei diesem Projekt Verluste erlitten hatten, Entschädigungen vom Land. Lange Zeit blieben die Versuche des Landes, einen Käufer für das Werk selbst zu finden - Anlagewert rund 8 Millionen DM - erfolglos. Dann wurden die Baulichkeiten um 150 000 DM in den 50er Jahren an eine elektrotechnische Fabrik verkauft.
Firma Rohrbach Zement
Die Firma Rohrbach Zement in Dotternhausen bei Balingen baut zur Herstellung von Portlandölschieferzement den Ölschiefer ab. Pro Tag werden ca. 800 Tonnen Schiefer gebrochen und in Wirbelschichtöfen verbrannt. Der im Wirbelschichtofen unter gezielten Bedingungen gebrannte Ölschiefer hat hydraulische Eigenschaften und ergibt mit Zementklinker vermahlen den Portlandölschieferzement. Bei der Verbrennung wird außerdem Dampf und Strom erzeugt. Die Leistung des firmeneigenen Kraftwerks reicht aus, um circa 95 % des Strombedarfs für die Zementherstellung zu decken. Außerdem wird feingemahlener Schiefer vor dem Drehofen dem Rohmehl aus Kalkmehl, Quarzsand und Ton beigemengt. Sein Energiegehalt hilft Kohle zu sparen, mit der der Drehofen befeuert wird. Auch ein Teil des Kalksteins - der mengenmäßig weitaus wichtigsten Komponente für die Zementherstellung - wird eingespart.Neben dieser wirtschaftlichen Nutzung werden aus dem Ölschiefer Fossilien geborgen, präpariert und in einem öffentlich zugänglichen Museum ausgestellt.
Hier liegen sie begraben, die Lebewesen aus längst vergangenen Zeiten. Der Bagger fördert zutage, was sich vor 190 Millionen Jahren, in der Jurazeit, auf dem Grund eines Meeres abgelagert hat. Im Ölschiefer sind die Versteinerungen der Urtiere besonders gut erhalten. Der Steinbruch liegt bei Dotternhausen, am Fuß der Schwäbischen Alb. Der Besitzer, die Firma Rohrbach Zement, hat zwei Präparatoren und einen Paläontologen angestellt. Sie sollen die wertvollsten Fossilien vor dem Brecher retten.
1000 Tonnen Ölschiefer werden hier täglich abgebaut. Der Steinbruch ist nicht sehr tief, denn die nutzbare Schicht ist gerade mal 10 Meter mächtig. Präparatoren und Arbeiter retten manch eine Versteinerung. Doch das meiste geht natürlich in die Brüche und wird mit den Steinbrocken im Brecher zertrümmert. Der Transport der Ölschiefer-Trümmer erfolgt auf einem kilometerlangen Förderband zum Zementwerk. Bis zum Jahr 2060 sollen die Vorräte reichen. Die ausgebeuteten Flächen werden rekultiviert, also wieder in Ackerland verwandelt. Das Zementwerk zwischen Rottweil und Balingen liegt direkt auf dem Ölschiefer. Von dort aufsteigend, folgen die jüngeren Gesteine der Jurazeit.
1000 Tonnen Ölschiefer werden hier täglich abgebaut. Der Steinbruch ist nicht sehr tief, denn die nutzbare Schicht ist gerade mal 10 Meter mächtig. Präparatoren und Arbeiter retten manch eine Versteinerung. Doch das meiste geht natürlich in die Brüche und wird mit den Steinbrocken im Brecher zertrümmert. Der Transport der Ölschiefer-Trümmer erfolgt auf einem kilometerlangen Förderband zum Zementwerk. Bis zum Jahr 2060 sollen die Vorräte reichen. Die ausgebeuteten Flächen werden rekultiviert, also wieder in Ackerland verwandelt. Das Zementwerk zwischen Rottweil und Balingen liegt direkt auf dem Ölschiefer. Von dort aufsteigend, folgen die jüngeren Gesteine der Jurazeit.
Das mit Ölschiefer befeuerte Kraftwerk ist die Hauptenergiequelle der Zementfabrik, deckt 95 Prozent des Strombedarfs. Allerdings verbrennt nur ein Teil des Gesteins. Es bleiben Mineralien übrig, die als Rohstoff in der Zementherstellung genutzt werden. Im Drehrohrofen herrscht eine Hitze von 2.000 Grad. Um hineinschauen zu können, müssen die Arbeiter einen Blendschutz vor Augen halten. Hier wird ein Gemisch aus Kalkstein, Ölschiefer, Ton und Sand zu Zement gebrannt. Der Ofen dreht sich ständig, damit das glühende Mineralgemisch nicht verklumpt. Der fertige Zement wird fein gemahlen in Säcke abgefüllt. Etwa ein Drittel davon stammt aus dem Ölschiefer.
Bei der Zementherstellung im allgemeinen werden vor allem Kalk und geringere Anteile von Ton und Sand benötigt. Die Rohstoffe werden zu Rohmehl verarbeitet, in großen Drehrohröfen bei 1450 °C zu Klinker gebrannt und anschließend mit geringen Mengen Gips zu Portlandzement vermahlen. Anders beim Zementwerk in Dotternhausen: Hier wird durch die Verwendung des Ölschiefers das obige Verfahren modifiziert.
Das Werk entstand dort, wo Kalk und Ölschiefer sehr nahe beieinanderliegen. Der Kalk wird auf dem 1000m hohen Plettenberg (Weißjura) gewonnen und anschließend mit einer Seilbahn in das 300m tiefer gelegene Werk transportiert. In einer großen Halle wird er zwischengelagert und Schwankungen in der Materialzusammensetzung ausgeglichen. Der Ölschiefer steht in unmittelbarer Nachbarschaft des Werks in einer Mächtigkeit von ca. 10m an. Er wird mit einem Mobilbrecher direkt im Steinbruch zerkleinert und mit Transportbändern einem Rundmischbett zugeführt. Für die Produktion muß er in sehr gleichmäßiger Form vorliegen. Durch die Nutzung des Ölschiefers ergeben sich für die Firma wirtschaftliche Vorteile gegenüber anderen Zementwerken. Ein positiver volkswirtschaftlicher Aspekt ist, daß beim Rohrbach-Verfahren die Energie eines sonst derzeit nicht ökonomisch nutzbaren Energieträgers hilft, andere Energiequellen einzusparen.
An drei verschiedenen Stellen innerhalb des Produktionsablaufs wird der Ölschiefer aufgrund seiner Zusammensetzung und seiner Eigenschaften eingesetzt.
- Direkte Zugabe des Schiefers mit Kalk, Ton und Sand in den Drehofen
(vgl. Calciumcarbonat und Tonanteile des Lias *): Der Schiefer wird dazu fein vermahlen und in einem besonderen Wärmetauschersystem dem Gemisch im Drehofen zugesetzt. Dabei verbrennen die organischen Bestandteile des Schiefers, wodurch andere Energieträger, die sonst zum Erhitzen gebraucht würden, eingespart werden können.
- Verbrennung des Ölschiefers im werkseigenen Kraftwerk zur Stromerzeugung:
Der Einsatz der Wirbelschichttechnik macht es möglich, daß der minderwertige Brennstoff Ölschiefer gezielt und gleichmäßig verbrannt werden kann. 800 Tonnen Ölschiefer werden den zwei Wirbelschichtöfen täglich zugeführt. Die organischen Bestandteile verbrennen bei einer konstanten Temperatur von ca. 800 °C. Es wird mit Hilfe von Dampf elektrische Energie erzeugt, die ca. 10 000 Haushalte mit Strom versorgen könnte. Aus technischen Gründen arbeitet das Kraftwerk rund um die Uhr und an sieben Tagen in der Woche. Überschüsse werden an das öffentliche Netz abgegeben. Wenn innerhalb des Betriebes viel elektrische Energie gebraucht wird, z.B. beim Betrieb der großen Zementmühlen, kauft man Strom zu. Die Leistung des werkseigenen Kraftwerks reicht aus, um über 80% des Strombedarfs für die Zementherstellung zu decken. Der Heizwert des Schiefers wird bei einem durchschnittlichen Gehalt von 11,2% organischer Substanz mit 3 900 kJ/kg angegeben. Das entspricht 0,13 SKE. Im Vergleich dazu beträgt der Heizwert von Erdöl: 42 300 kJ/kg; Steinkohle: 29 300 kJ/kg; Braunkohle: 8 000 kJ/kg.
- Verwendung der Verbrennungsrückstände des Schiefers als Zementinhaltsstoffe:
Dadurch wird die Verbrennung im Kraftwerk erst wirtschaftlich. Die im Wirbelschichtofen unter gezielten Bedingungen getemperten Ölschiefermineralien haben hydraulische Eigenschaften. Das bedeutet, daß sie selbst (wie Zement) mit Wasser angemacht, sowohl an der Luft als auch unter Wasser erhärten. So läßt sich der bei der Verbrennung des Schiefers erhaltene Abbrand oder gebrannte Ölschiefer direkt als Inhaltsstoff zur Zementherstellung verwenden. Man mischt ihn mit Zementklinker statt Gips und erhält auf diese Weise den sog. Ölschieferzement.
Die Nutzung von Ölschiefern zur Ölgewinnung kam zuletzt in den 70er Jahren dieses Jahrhunderts infolge der "Ölkrise" -wieder- in die Diskussion. Amerikanische Behörden haben damals die Übersetzung deutscher Berichte über die Ölgewinnung aus Ölschiefer in Auftrag gegeben. Es wird in jener Zeit auch von Pilotanlagen als Vorstufen größeren industriellen Engagements in den USA und Brasilien und von der Schieferölgewinnung in China berichtet. In Estland werden Ölschiefer schon seit geraumer Zeit im wesentlichen durch direkte Verbrennung in Kraftwerken und in der Stadtgasproduktion eingesetzt. Allerdings liegen Gehalte der dortigen Ölschiefer viel höher als in Württemberg.
Bei Nutzung von Ölschiefern ergeben sich zwei grundlegende Schwierigkeiten. Erstens die außerordentlich große chemische Widerständigkeit des Kerogens. Zweitens seine überaus intensive Vermengung mit den feinkörnigen mineralischen Komponenten des Gesteins. Eine wirtschaftliche Nutzung ist daher zur Zeit nur gegeben, wenn die Kohlenstoffgehalte des Ölschiefers sehr hoch sind, oder das Gestein als ganzes (wie bei der Zementherstellung in Dotternhausen) genutzt werden kann. Außerdem muß betont werden, daß die Ölschiefer-industrien zur Ölgewinnung auch immer mit wirksamen Umweltschutzmaßnahmen ausgestattet sein sollten, um die Emissionen an Stickoxiden, Schwefelverbindungen, Kohlenmonoxid, Ozon, Phenolen und Kohlenwasserstoffen klein zu halten.
Einige dieser Schwierigkeiten könnten in Zukunft möglicherweise vermindert werden, wenn man versucht, die Schiefer mit "in-situ-Techniken" zu nutzen. Solche werden seit Jahren von amerikanischen Firmen im Gebiet der Green River-Ölschiefer erprobt. Zunächst wird dabei von Bohrlöchern aus durch Sprengstoffe oder auch elektrische Entladungen der Ölschiefer an Ort und Stelle unter Tage zerrüttet. Anschließend wird Luft eingepreßt, der Schiefer entzündet und das sich vor der Flammenfront sammelnde Schwelöl abgepumpt. Modifizierte "In-situ"-Verfahren sehen den Vortrieb von Stollen in den Ölschiefer vor, die bei der nachfolgenden Sprengung verfüllt werden, wodurch sich die notwendige Porosität und Durchlässigkeit des Flözes erhöht. Weiterhin wird das Einpressen heißer Gase oder aggresiver Dämpfe anstelle von Luft erwogen. (Vergleiche dazu Untertage-Verschwelung in Schörzingen während des II. Weltkriegs !!) Dem Ziel, Kerogene von ihrem mineralischen Ballast abzutrennen, gelten vor allem in den USA unternommene Experimente, die man unter dem Begriff "bioleaching" zusammenfaßt. Hochspezialisierte Bakterienarten sollen hierbei die engen Bindungen zwischen Kerogen und Mineralien lösen bzw. die Mineralien völlig zersetzen. Bestrebungen in anderen Ländern gehen dahin, Kerogene auf "kaltem Wege" durch vorsichtige Oxidation in wasserlösliche Verbindungen überzuführen, die für die Synthese vieler chemischer Produkte, z.B. Kunststoffe, verwandt werden könnten.
Die Chance Ölschiefer in Zukunft in großem Stil zur Energiegewinnung heranzuziehen, ist negativ zu bewerten. Wie bei jedem fossilen Rohstoff sind die Vorräte begrenzt. Im übrigen würde mit der Nutzung ebenfalls ein Kohlendioxidausstoß verbunden sein, was hinsichtlich des globalen Klimas nicht unproblematisch ist.
Ölschiefer stellt an sich einen wertvollen Rohstoff dar, kann aber die anderen fossilen Energieträger keinesfalls ersetzen. Er sollte nach Möglichkeit nicht nur zur Energieerzeugung genutzt werden. Die Verfahren zur Ölschieferverwertung müssen hinsichtlich Rentabilität, Umweltverträglichkeit und eventueller Nebenprodukte weiter optimiert werden.
Ölschieferzement zeigt im Vergleich zu Portlandzement geringere Festigkeit. Besondere Verfahrenstechniken ermöglichen es aber ihn so zu produzieren, daß er eine rotbraune Eigenfarbe bekommt. Dies macht ihn besonders zur architektonischen Gestaltung attraktiv. Das Zementwerk hat eine Belegschaft von ca. 200 Personen. Davon arbeiten 33% in der Produktion, 43% sind mit der Wartung der Anlagen beschäftigt und 24% sind in Verwaltung und Verkauf tätig.
Kromer und Fossiliensammler mit Meißel spalten Platte
SWR - Screenshot aus der Sendung
Ein-Mann-Betriebe
Die Ölschiefer-Steinbrüche in Holzmaden sind kleine Ein-Mann-Betriebe. Kurt Kromer birgt alleine, nur mit Hilfe seiner Maschinen, tonnenschwere Ölschiefer-Platten, Rohmaterial für die Produktion von Tischplatten. Zunächst füllt er Schwarzpulver in ein Bohrloch. Per Kabel zündet er die Explosion - aus sicherer Distanz. Nur eine kleine Sprengung, damit der Gesteinsblock nicht völlig zerbröselt. Die Ölschieferplatten werden vorsichtig gespalten, um die Versteinerungen nicht zu zertrümmern. Heute sind zwei Helfer da, Fossilienliebhaber, die ihren Urlaub im Steinbruch verbringen. Wenn die Versteinerungen besonders groß oder wertvoll sind, holt Kurt Kromer Hilfe aus dem Museum Hauff. Der Präparator des Museums ist Spezialist für Puzzlespiele dieser Art. Es geht darum, alle Teile des Sauriers richtig zusammenzufügen, sie so zu markieren, daß nichts verlorengeht.